#داروهای_پپتیدی
مزایای داروهای پپتیدی:
مولکول های دارویی کوچک در حال حاضر تنها بخش درصد کمی از پروتئین های داخلی و خارج سلولی را مورد هدف قرار می دهند. از معمولترین پروتئین هایی که به عنوان اهداف دارویی می باشند می توان به گیرنده های متصل شونده به پروتئین ها، آنزیم ها، گیرنده های هسته ای، و کانال های یونی اشاره کرد که همه آنها مولکول های کوچک طبیعی را به عنوان سوبسترا دارند.
بیشتر این داروها پاکت اتصالی سوبسترا روی پروتئین را به طور مستقیم مورد هدف قرار می دهند، اما گاهی اوقات به نواحی آلوستریک را نیز متصل می شوند.
سطحی اتصالی بین مولکول های لیگاند (سوبسترا) و پروتئین بین 300 تا 1000 آنگستروم مربع متغیر می باشد. و این در حالی است که این سطح برای میانکنش های پروتئین-پروتئین بسیار سطح صاف و بزرگ بوده و بین 1200 تا 3000 متغیر است. بیشتر انرژی آزاد اتصالی مربوط به چند آمینواسید کلیدی درگیر در اتصال می باشد که به آنها hotspot residue گفته می شود.
شبکه های میانکنشی به صورت پخش شده بوده و از یک معماری خاصی برخوردار می باشد و آنالیزها نشان می دهد که "میانکنش های قوی تعاونی" در این بین برقرار می باشد.
و این در حالی است که سطوح اتصالی در پروتئین-پپتید نیز از این سطح در میانکنش های پروتئین-پروتئین کوچکتر بوده و با این حال بسیار بزرگتر از سطوح میانکنشی پروتئین-لیگاند می باشد.
با توجه به مباحثی که ذکر شد می توان چنین برداشت که جهت مهار میانکنش های پروتئین-پروتئین پپتیدها با توجه به سطح اتصالی بزرگتر نسبت به لیگاندها و مولکول های کوچک گزینه های مناسبتری برای مباحث دارویی می باشند.
@computational_science
مزایای داروهای پپتیدی:
مولکول های دارویی کوچک در حال حاضر تنها بخش درصد کمی از پروتئین های داخلی و خارج سلولی را مورد هدف قرار می دهند. از معمولترین پروتئین هایی که به عنوان اهداف دارویی می باشند می توان به گیرنده های متصل شونده به پروتئین ها، آنزیم ها، گیرنده های هسته ای، و کانال های یونی اشاره کرد که همه آنها مولکول های کوچک طبیعی را به عنوان سوبسترا دارند.
بیشتر این داروها پاکت اتصالی سوبسترا روی پروتئین را به طور مستقیم مورد هدف قرار می دهند، اما گاهی اوقات به نواحی آلوستریک را نیز متصل می شوند.
سطحی اتصالی بین مولکول های لیگاند (سوبسترا) و پروتئین بین 300 تا 1000 آنگستروم مربع متغیر می باشد. و این در حالی است که این سطح برای میانکنش های پروتئین-پروتئین بسیار سطح صاف و بزرگ بوده و بین 1200 تا 3000 متغیر است. بیشتر انرژی آزاد اتصالی مربوط به چند آمینواسید کلیدی درگیر در اتصال می باشد که به آنها hotspot residue گفته می شود.
شبکه های میانکنشی به صورت پخش شده بوده و از یک معماری خاصی برخوردار می باشد و آنالیزها نشان می دهد که "میانکنش های قوی تعاونی" در این بین برقرار می باشد.
و این در حالی است که سطوح اتصالی در پروتئین-پپتید نیز از این سطح در میانکنش های پروتئین-پروتئین کوچکتر بوده و با این حال بسیار بزرگتر از سطوح میانکنشی پروتئین-لیگاند می باشد.
با توجه به مباحثی که ذکر شد می توان چنین برداشت که جهت مهار میانکنش های پروتئین-پروتئین پپتیدها با توجه به سطح اتصالی بزرگتر نسبت به لیگاندها و مولکول های کوچک گزینه های مناسبتری برای مباحث دارویی می باشند.
@computational_science
#داروهای_پپتیدی نمونه ای از میانکنش مولکول های مختلف با پروتئین ها @computational_science
مطالعه این مطالب و استفاده از آنها توسط شما دوستان عزیز باعث قوت قلب ما برای ارائه مطالب کاملتر و بهتر می باشد. ممنون از همه شما @computational_science
#داروهای_پپتیدی
همانطور که قبلا هم اشاره شده بود پپتیدها را هم می توان از طریق متدهای آزمایشگاهی طراحی کرد و هم می توان از طریق روش کامپیوتری ومحاسباتی مورد مطالعه قرار داد.
در کل طراحی پپتید به دو روش وابسته به ساختار و مستقل از ساختار می باشد که در زبان انگلیسی به صورت زیر نام گذاری می شوند.
1- Structure-free peptide design
2- Structure-base peptide design
در روش اول به هیچ ساختاری دسترسی وجود ندارد و این روش در مواقعی استفاده می شود که ساختار مولکول ها موجود نباشد. این روش در آزمایشگاه و با استفاده از روش های نمایش فاژی می باشد و در کار محاسباتی از شبکه های عصبی برای بدست آوردن پپتید مورد نظر استفاده می شود.
در روش دوم که طراحی برپایه ساختار می باشد سه روش مختلف برای این مرحله موجود است که عبارتند از:
1- استخراج پپتیدها از کمپلکس های پروتئینی موجود
2- داکینگ پپتیدها و طراحی de novo پپتید
3- بهینه کردن تمایل اتصال
تک تک این روش ها در پست های بعدی به صورت کامل توضیح داده خواهد شد.
@computational_science
همانطور که قبلا هم اشاره شده بود پپتیدها را هم می توان از طریق متدهای آزمایشگاهی طراحی کرد و هم می توان از طریق روش کامپیوتری ومحاسباتی مورد مطالعه قرار داد.
در کل طراحی پپتید به دو روش وابسته به ساختار و مستقل از ساختار می باشد که در زبان انگلیسی به صورت زیر نام گذاری می شوند.
1- Structure-free peptide design
2- Structure-base peptide design
در روش اول به هیچ ساختاری دسترسی وجود ندارد و این روش در مواقعی استفاده می شود که ساختار مولکول ها موجود نباشد. این روش در آزمایشگاه و با استفاده از روش های نمایش فاژی می باشد و در کار محاسباتی از شبکه های عصبی برای بدست آوردن پپتید مورد نظر استفاده می شود.
در روش دوم که طراحی برپایه ساختار می باشد سه روش مختلف برای این مرحله موجود است که عبارتند از:
1- استخراج پپتیدها از کمپلکس های پروتئینی موجود
2- داکینگ پپتیدها و طراحی de novo پپتید
3- بهینه کردن تمایل اتصال
تک تک این روش ها در پست های بعدی به صورت کامل توضیح داده خواهد شد.
@computational_science
Forwarded from 🔷شبکه بیوانفورماتیک و بیولوژی محاسباتی ایران🔷
درباره مرکز زیست محاسبات پویا
زیست محاسبات پویا به عنوان اولین و تنها شرکت فعال در حوزه محاسبات دارویی (Computational Pharmaceutics) خدمات متعددی به منظور طراحی دارو، طراحی زیست داروها، بررسی ویژگی های فیزیکوشیمیایی داروها، فرمولاسیون، رهایش دارو و دارورسانی هدفمند ارائه می کند.
زیست محاسبات پویا با بهره گیری از رایانه های پیشرفته، همکاری با بهترین نیروهای متخصص و مجرب کشور و مطابق با استانداردهای جهانی، اقدام به بومی سازی این علوم نموده و تاکنون توانسته است پاسخگوی طیف گسترده ای از نیازهای جامعه ی دانشگاهی و تحقیقاتی کشور باشد.
www.zistpooya.com
@computational_science
زیست محاسبات پویا به عنوان اولین و تنها شرکت فعال در حوزه محاسبات دارویی (Computational Pharmaceutics) خدمات متعددی به منظور طراحی دارو، طراحی زیست داروها، بررسی ویژگی های فیزیکوشیمیایی داروها، فرمولاسیون، رهایش دارو و دارورسانی هدفمند ارائه می کند.
زیست محاسبات پویا با بهره گیری از رایانه های پیشرفته، همکاری با بهترین نیروهای متخصص و مجرب کشور و مطابق با استانداردهای جهانی، اقدام به بومی سازی این علوم نموده و تاکنون توانسته است پاسخگوی طیف گسترده ای از نیازهای جامعه ی دانشگاهی و تحقیقاتی کشور باشد.
www.zistpooya.com
@computational_science
#داروهای_پپتیدی
Tumor homing peptides (THP)
پپتیدهای کوچک با طول حدود 3 تا 15 آمینواسید هستند که به سلول های توموری و همچنین به رگ های آنها وصل می شوند. از وقتی که در سال 1998 تفکر Tomur homing مطرح شده است تعداد زیادی THP در in vitro و in vivo به وسیله تکنولوژی نمایش فاژی نشان ارائه شده است.
این پپتید ها (THP) به طور معمول دارای موتیف های RGD و NGR می باشند که به طور اختصاصی به سطح مولکولی سلولها و رگ های توموری متصل می شود.
برای مثال پپتید RGD به آلفا اینتگرین وصل می شوند و پپتید NGR به گیرنده آمینوپپتیدازی که در سطح سلول های اندوتلیال توموری قرار دارند متصل می شود.
با توجه به این قابلیت پپتیدهای THP ازین پپتیدها برای شناسایی و درمان بیماری توموری استفاده می شود.
با توجه به اینکه این پپتیدها نقش مهمی در تشخیص و درمان بیماری سرطان دارند ارائه الگوریتم و نرم افزاری جهت ارائه THP های جدید، دروازه های تازه ای را در درمان بیماری سرطان باز می کند. استفاده ازین سرورها می تواند به اندازه زیادی در هزینه و زمان صرفه جویی داشته باشد.
لینک سرور به صورت زیر می باشد.
http://crdd.osdd.net/raghava/tumorhpd/
و لینک مقاله مربوط به این سرور نیز به صورت زیر می باشد.
http://www.nature.com/articles/srep01607
www.zistpooya.com
@computational_science
Tumor homing peptides (THP)
پپتیدهای کوچک با طول حدود 3 تا 15 آمینواسید هستند که به سلول های توموری و همچنین به رگ های آنها وصل می شوند. از وقتی که در سال 1998 تفکر Tomur homing مطرح شده است تعداد زیادی THP در in vitro و in vivo به وسیله تکنولوژی نمایش فاژی نشان ارائه شده است.
این پپتید ها (THP) به طور معمول دارای موتیف های RGD و NGR می باشند که به طور اختصاصی به سطح مولکولی سلولها و رگ های توموری متصل می شود.
برای مثال پپتید RGD به آلفا اینتگرین وصل می شوند و پپتید NGR به گیرنده آمینوپپتیدازی که در سطح سلول های اندوتلیال توموری قرار دارند متصل می شود.
با توجه به این قابلیت پپتیدهای THP ازین پپتیدها برای شناسایی و درمان بیماری توموری استفاده می شود.
با توجه به اینکه این پپتیدها نقش مهمی در تشخیص و درمان بیماری سرطان دارند ارائه الگوریتم و نرم افزاری جهت ارائه THP های جدید، دروازه های تازه ای را در درمان بیماری سرطان باز می کند. استفاده ازین سرورها می تواند به اندازه زیادی در هزینه و زمان صرفه جویی داشته باشد.
لینک سرور به صورت زیر می باشد.
http://crdd.osdd.net/raghava/tumorhpd/
و لینک مقاله مربوط به این سرور نیز به صورت زیر می باشد.
http://www.nature.com/articles/srep01607
www.zistpooya.com
@computational_science
#داروهای_پپتیدی
Membrane-Tethered Ligands
تشخیص مولکول های ترشحی حاوی سیگنال و پیام ها که توسط گیرنده های سطح سلولی ترشح می شوند و به عنوان یک عامل ارتباطی بین سلول ها عمل می کنند بسیار پر اهمیت است و درک این اتصالات است که به ما این اجازه را می دهد که ارتباط عملکردی سلول ها را بشناسیم. برای این منظور طراحی پپتید هایی به عنوان لیگاند که باعث شناسایی و دستکاری این رسپتور های سطح سلول می شود از اهمیت خاصی برخوردار است. در این پژوهش نیز طراحی لیگاند غشایی که Membrane-tethered ligands نام دارند و امکان دستکاری فعالیت رسپتورهای مورد نظر و شناسایی آن ها را امکان پذیر می کند، مورد بررسی قرار گرفته است. در این روش که امروز بسیار کاربرد دارد یک پپتید به عنوان لیگاند طراحی می شوند و بر روی رسپتور قرار می گیرد. لیگاند مورد نظر بعد از اینکه بر روی رسپتور قرار می گیرد می تواند عمل رسپتور مورد نظر را تقویت و یا تضعیف کند و در واقع عمل آن را کنترل کند و به طور کلی می توان گفت که ما می توانیم عملکرد سلول مورد نظر و ارتباط آن با سایر سلول ها را نیز کنترل کنیم. برای مثال در شکل زیر نمونه هایی از این لیگاند ها را مشاهده می کنیم.
لینک مقاله مربوطه:
http://www.ncbi.nlm.nih.gov/pubmed/23636262
@computational_science
Membrane-Tethered Ligands
تشخیص مولکول های ترشحی حاوی سیگنال و پیام ها که توسط گیرنده های سطح سلولی ترشح می شوند و به عنوان یک عامل ارتباطی بین سلول ها عمل می کنند بسیار پر اهمیت است و درک این اتصالات است که به ما این اجازه را می دهد که ارتباط عملکردی سلول ها را بشناسیم. برای این منظور طراحی پپتید هایی به عنوان لیگاند که باعث شناسایی و دستکاری این رسپتور های سطح سلول می شود از اهمیت خاصی برخوردار است. در این پژوهش نیز طراحی لیگاند غشایی که Membrane-tethered ligands نام دارند و امکان دستکاری فعالیت رسپتورهای مورد نظر و شناسایی آن ها را امکان پذیر می کند، مورد بررسی قرار گرفته است. در این روش که امروز بسیار کاربرد دارد یک پپتید به عنوان لیگاند طراحی می شوند و بر روی رسپتور قرار می گیرد. لیگاند مورد نظر بعد از اینکه بر روی رسپتور قرار می گیرد می تواند عمل رسپتور مورد نظر را تقویت و یا تضعیف کند و در واقع عمل آن را کنترل کند و به طور کلی می توان گفت که ما می توانیم عملکرد سلول مورد نظر و ارتباط آن با سایر سلول ها را نیز کنترل کنیم. برای مثال در شکل زیر نمونه هایی از این لیگاند ها را مشاهده می کنیم.
لینک مقاله مربوطه:
http://www.ncbi.nlm.nih.gov/pubmed/23636262
@computational_science
PubMed
Membrane-tethered ligands: tools for cell-autonomous pharmacological manipulation of biological circuits - PubMed
Detection of secreted signaling molecules by cognate cell surface receptors is a major intercellular communication pathway in cellular circuits that control biological processes. Understanding the biological significance of these connections would allow us…
Membrane-tethered ligands @computational_science
#داروهای_پپتیدی
استفاده از پپتید به عنوان حامل دارو
Filamentous supramolecular peptide–drug conjugates as highly efficient drug delivery vehicles:
امروزه پپتید ها علاوه بر اینکه به عنوان دارو طراحی می شوند می توانند به عنوان حامل مواد دارویی نیز مورد استفاده قرار گیرند. لذا در این تحقیق یک ابرمولکول رشته ای متشکل از دارو و پپتید (Filamentous supramolecular peptide–drug conjugates) طراحی شده است. و بررسی نشان داده است که بهره وری بارگیری و اثربخشی داروی ضد سرطانی مورد نظر که برای شیمی درمانی مورد استفاده بوده است، با این روش تا 100% افزایش یافته است. این حامل پپتیدی همچنین نسبت به سایر نانوحامل ها و نانوذرات نیمه عمر بالایی دارد. به طور کلی در این روش از یک پپتید که تمایل به تشکیل ساختار صفحه بتا (B-sheet) دارد به عنوان حامل استفاده شده است. فرایند به این صورت است که دارو داخل این پپتید قرار می گیرد و سپس پپتید به صورت خود تجمعی و با تشکیل ساختار های صفحه بتا دارو را در بر می گیرد و سپس این پپتید با استفاده از پلی اتیلن گلیکول پوشانده می شود و تشکیل ابرمولکول می دهد. پلی اتیلن گلیکول باعث می شود که نیمه عمر این حامل افزایش پیدا کند. علاوه بر این پپتید طوری طراحی می شود که وقتی به بافت هدف می رسد خاصیت خود تجمعی خود را از دست می دهد و داروی مورد نظر آزاد می شود. در شکل زیر تصویر مربوط به این حامل ابرمولکولی را مشاهده می کنیم.
@computational_science
استفاده از پپتید به عنوان حامل دارو
Filamentous supramolecular peptide–drug conjugates as highly efficient drug delivery vehicles:
امروزه پپتید ها علاوه بر اینکه به عنوان دارو طراحی می شوند می توانند به عنوان حامل مواد دارویی نیز مورد استفاده قرار گیرند. لذا در این تحقیق یک ابرمولکول رشته ای متشکل از دارو و پپتید (Filamentous supramolecular peptide–drug conjugates) طراحی شده است. و بررسی نشان داده است که بهره وری بارگیری و اثربخشی داروی ضد سرطانی مورد نظر که برای شیمی درمانی مورد استفاده بوده است، با این روش تا 100% افزایش یافته است. این حامل پپتیدی همچنین نسبت به سایر نانوحامل ها و نانوذرات نیمه عمر بالایی دارد. به طور کلی در این روش از یک پپتید که تمایل به تشکیل ساختار صفحه بتا (B-sheet) دارد به عنوان حامل استفاده شده است. فرایند به این صورت است که دارو داخل این پپتید قرار می گیرد و سپس پپتید به صورت خود تجمعی و با تشکیل ساختار های صفحه بتا دارو را در بر می گیرد و سپس این پپتید با استفاده از پلی اتیلن گلیکول پوشانده می شود و تشکیل ابرمولکول می دهد. پلی اتیلن گلیکول باعث می شود که نیمه عمر این حامل افزایش پیدا کند. علاوه بر این پپتید طوری طراحی می شود که وقتی به بافت هدف می رسد خاصیت خود تجمعی خود را از دست می دهد و داروی مورد نظر آزاد می شود. در شکل زیر تصویر مربوط به این حامل ابرمولکولی را مشاهده می کنیم.
@computational_science
#داروهای_پپتیدی استفاده از پپتیدها به عنوان حامل دارویی @computational_science
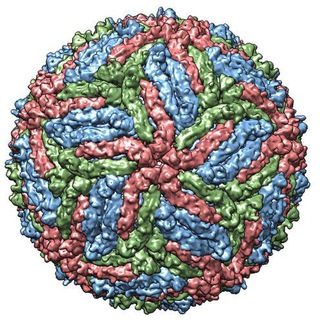
The cryo-EM structure of Zika Virus
@computational_science
@computational_science
تصویر بالا مربوط به ویروس زیکا (zika) می باشد که برای تصویر برداری آن از میکروسکوپ cryo-EM استفاده شده است. این تصویر ازین به بعد به عنوان لوگوی کانال و گروه (البته تا مدت زمانی) مورد استفاده قرار خواهد گرفت.
Cryo-electron microscopy
این میکروسکوپ که به طور خلاصه به صورت cryo-em گفته می شود شکلی از میکروسکوپ TEM (و یا به عبارتی transmission electron microscopy) می باشد که جهت تصویر برداری مولکولیهای زیستی در دماهای cryogenic مورد استفاده قرار میگیرد.
دماهایی cryogenic: در علم فیزیک به مطالعه رفتار مواد در دماهای پایین cryogenic گفته می شود. و تقریبا به دمای کمتر از منفی 150 درجه سانتیگراد دمای cryogenic اطلاق می گردد.
در علم بیولوژی برای مطالعه ساختار مولکول های بزرگ مانند ریبوزوم ها، میتوکندی ها و ... از این میکروسکوپ استفاده می شود و محیطی که برای ایجاد دمای cryogenic مورد استفاده قرار میگیرد اکثرا نیتروژن مایع می باشد.
در حال حاضر این دقت (resolution) این تکنیک به طور پیوسته در حال افزایش می باشد.
@computational_science
این میکروسکوپ که به طور خلاصه به صورت cryo-em گفته می شود شکلی از میکروسکوپ TEM (و یا به عبارتی transmission electron microscopy) می باشد که جهت تصویر برداری مولکولیهای زیستی در دماهای cryogenic مورد استفاده قرار میگیرد.
دماهایی cryogenic: در علم فیزیک به مطالعه رفتار مواد در دماهای پایین cryogenic گفته می شود. و تقریبا به دمای کمتر از منفی 150 درجه سانتیگراد دمای cryogenic اطلاق می گردد.
در علم بیولوژی برای مطالعه ساختار مولکول های بزرگ مانند ریبوزوم ها، میتوکندی ها و ... از این میکروسکوپ استفاده می شود و محیطی که برای ایجاد دمای cryogenic مورد استفاده قرار میگیرد اکثرا نیتروژن مایع می باشد.
در حال حاضر این دقت (resolution) این تکنیک به طور پیوسته در حال افزایش می باشد.
@computational_science
#داروهای_پپتیدی
Development of Protein Mimics for Intracellular Delivery:
پیشرفت و استفاده از مقلدهای پروتئینی(داربست های پروتئینی) برای تحویل و انتقال مواد به داخل سلول:
استفاده از پپتید ها به عنوان دارو امروزه به صورت رایج در حال انجام است. مبحث بعدی در این حیطه استفاده از پپتید ها و پروتئین ها به عنوان حامل دارو است. ولی وقتی پپتید ها به عنوان حامل استفاده می شوند باید ثبات دارو، حفظ حلالیت دارو و تحویل و آزادسازی دارو را فراهم سازند. که از بین این موارد رهاسازی دارو در بافت هدف به صورت کارآمد و تحویل دارو به داخل سلول از اهمیت زیادی برخوردار است.لذا برای رسیدگی به این مشکلات گروهی از محققان از طبیعت الهام گرفته اند.در واقع می توان از پروتئین هایی که شکل مناسب دارند و قادر به عبور از غشائ سلولی هستند به عنوان حامل داروها و پپتید ها استفاده کرد. در شکل زیر دو نمونه از این پروتئین ها را مشاهده می کنیم.
@computational_science
Development of Protein Mimics for Intracellular Delivery:
پیشرفت و استفاده از مقلدهای پروتئینی(داربست های پروتئینی) برای تحویل و انتقال مواد به داخل سلول:
استفاده از پپتید ها به عنوان دارو امروزه به صورت رایج در حال انجام است. مبحث بعدی در این حیطه استفاده از پپتید ها و پروتئین ها به عنوان حامل دارو است. ولی وقتی پپتید ها به عنوان حامل استفاده می شوند باید ثبات دارو، حفظ حلالیت دارو و تحویل و آزادسازی دارو را فراهم سازند. که از بین این موارد رهاسازی دارو در بافت هدف به صورت کارآمد و تحویل دارو به داخل سلول از اهمیت زیادی برخوردار است.لذا برای رسیدگی به این مشکلات گروهی از محققان از طبیعت الهام گرفته اند.در واقع می توان از پروتئین هایی که شکل مناسب دارند و قادر به عبور از غشائ سلولی هستند به عنوان حامل داروها و پپتید ها استفاده کرد. در شکل زیر دو نمونه از این پروتئین ها را مشاهده می کنیم.
@computational_science
#داروهای_پپتیدی
در شکل بالا یکی پروتئین HIV-1 TAT است و دیگری پروتئین antennapedia homeodomainاست. در واقع در این روش از قالب ساختاری پروتئین های مورد نظر به عنوان داربست استفاده می شود و دارو یا پپتید بر روی این داربست قرار می گیرد و چون پروتئین مورد نظر ما به صورت طبیعی دارای خاصیت عبور از غشاء سلولی می باشد وقتی که به بافت هدف می رسد می تواند دارو یا پپتید مورد نظر را از داخل غشاء عبور دهد و داخل سلول آزاد کند. در شکل زیر نیز تعدادی از مقلد ها یا داربست های پروتئیینی که در طی الیان متوالی و به ترتیب پیشرفت کرده اند را مشاهده میکنیم.
@computational_science
در شکل بالا یکی پروتئین HIV-1 TAT است و دیگری پروتئین antennapedia homeodomainاست. در واقع در این روش از قالب ساختاری پروتئین های مورد نظر به عنوان داربست استفاده می شود و دارو یا پپتید بر روی این داربست قرار می گیرد و چون پروتئین مورد نظر ما به صورت طبیعی دارای خاصیت عبور از غشاء سلولی می باشد وقتی که به بافت هدف می رسد می تواند دارو یا پپتید مورد نظر را از داخل غشاء عبور دهد و داخل سلول آزاد کند. در شکل زیر نیز تعدادی از مقلد ها یا داربست های پروتئیینی که در طی الیان متوالی و به ترتیب پیشرفت کرده اند را مشاهده میکنیم.
@computational_science